Кристаллические решетки - Физика в школе


Главное меню:
статьи
Кристаллические решетки
 Окружающий нас мир состоит из атомов. Есть три состояния вещества — кристаллическое тело жидкость и газ. Три состояния отличаются разными свойствами, так как имеют неодинаковое атомное строение.
Окружающий нас мир состоит из атомов. Есть три состояния вещества — кристаллическое тело жидкость и газ. Три состояния отличаются разными свойствами, так как имеют неодинаковое атомное строение. Давайте сегодня поговорим о кристаллах. А какие другие вещества, кроме поваренной соли, относятся к кристаллическим телам? Запомните - большинство встречающихся в природе и технике веществ имеет кристаллическую структуру.
Например, песчинка - тоже кристалл. Правда, по сравнению с поваренной солью, её форма менее регулярна, но при увеличении в 100 миллионов раз мы тоже увидим упорядоченную сеть атомов кислорода (0) и кремния (Si). Все металлы (за исключением ртути), драгоценные камни (рубин, бриллиант, сапфир и т. д.), а также многие органические соединения (например, сахар) имеют кристаллическое строение.
Рассматривая под микроскопом кристалл поваренной соли (NaCl) и двуокиси кремния SiO), мы сразу замечаем не только то, что они состоят из разных атомов, но и то, что атомы образуют неодинаковые пространственные решетки.
Именно кристаллическая решетка во многом обуславливает свойства различных веществ. Чтобы убедиться в этом, давайте ближе познакомимся с кристаллами углерода — наиболее распространенного в природе химического элемента. Одной из разновидностей чистого углерода является графит, а он вам хорошо известен. Из графита изготовляют, между прочим, стержни карандашей и непроволочных резисторов.
Графит — очень мягкий, легко раскалываемый минерал, он хорошо поддаётся механической обработке. Какова кристаллическая решетка графита? При большом увеличении мы видим, что атомы углерода образуют что-то наподобие сотовых ячеек: отдельные плоскости, состоящие из шестиугольников, расположены рядами. Причём атомы одного ряда тесно связаны между собой, а связь между отдельными рядами — более слабая. Вот почему даже при легком нажатии кусочек графита ломается. По шкале Мооса твёрдость графита равна 1, а у алмаза — второй разновидности углерода - наивысшая твёрдость 10 .
Чем это объясняется? Безусловно, кристаллической решеткой. В алмазе каждый атом углерода тесно связан с четырьмя соседними атомами, лежащими в вершинах правильной треугольной пирамиды (такая пирамида называется тетраэдром).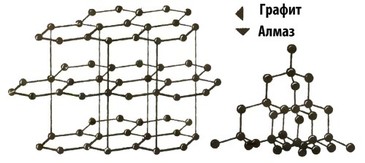

Обратите внимание на кристаллические решетки графита и алмаза. Регулярное расположение атомов периодически повторяется в пространстве. Это значит, что если мы заглянем внутрь какого-нибудь кристалла, то в любом месте (сбоку, сверху или в центре) увидим такую же сеть атомов. Поэтому при описании строения какого-нибудь кристаллического тела можно рассматривать его наименьшую частичку, из которых как из кубиков можно построить целый большой кристалл. Физики охотно пользуются именно таким методом, а наименьшую частицу кристалла обычно называют элементарной ячейкой.
А сколько существует видов кристаллических решеток? Конечно, очень много, но в зависимости от формы элементарной ячейки их объединяют в семь основных групп. Вполне понятно, что в природе некоторые ячейки имеют посторонние примеси, т. е. инородные атомы, но от этого основные свойства частицы не меняются.
Чтобы лучше представить, как выглядят некоторые кристаллы, попробуйте построить из пластилина и спичек какую-нибудь модель кристаллической решетки. Интересно, получится ли у вас пространственная решетка графита или алмаза.